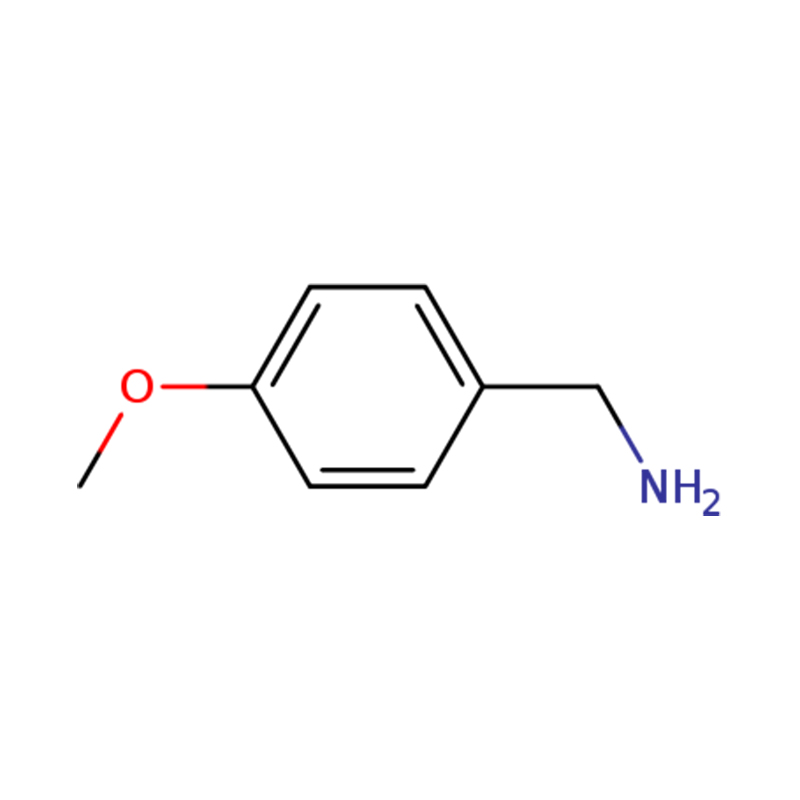
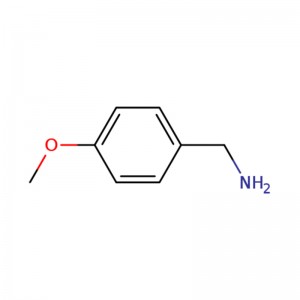
1-(4-METOKSYFENYLO)METANAMINA
Szczegóły produktu
| Kasa nr | 2393-23-9 | Czas dostawy | w ciągu 10 dni |
| Molekularny | C8H11NO | Zdolność produkcyjna | 1 tona metryczna/dzień |
| Wygląd | Przejrzysta, bezbarwna lub lekko żółta ciecz | Czystość | 99% min |
| Aplikacja | Półprodukty farmaceutyczne | Składowanie | Temperatura pokojowa, ciemność, szczelnie zamknięte |
| LimitNum | 1 kilogram | Transport | Lotniczy, morski, ekspresowy. |
| Gęstość | 1,05 g/mlSzerokość 25°C(lit.) | Punkt wrzenia | 236-237°C(lit.) |
| Punkt topnienia | -10°C | Współczynnik załamania światła | n20/D1.546(lit.) |
| Punkt zapalny: | >230°F | Rozpuszczalność | Dobrze rozpuszczalny w wodzie |
| Nazwa | p-anisyloamina lub (4-metoksyfenylo)metanoamina |
Synonimy
LABOTEST-BB LTBB000703; AKOS BBS-00003589; 4-AMINOMETYLOANISOL; 4-METOKSYBENZYLOAMINA; chlorowodorek p-metoksybenzyloaminy 173,64; 4-metoksybenzyloamina, 98+%; do sparfloksacyny; CHLOROWODOREK P-METOKSYBENZYLOAMINY
Aplikacja
Może być stosowany do syntezy półproduktów farmaceutycznych. Jest nieznacznie szkodliwy dla wody. Nie dopuszczać do kontaktu nierozcieńczonych lub dużych ilości produktu z wodami gruntowymi, ciekami wodnymi ani systemami kanalizacyjnymi. Bez zezwolenia władz nie należy wylewać materiałów do otaczającego środowiska, aby uniknąć kontaktu z tlenkami, kwasami, powietrzem i dwutlenkiem węgla. Pojemnik należy przechowywać szczelnie zamknięty, umieścić w szczelnym ekstraktorze i przechowywać w chłodnym, suchym miejscu.
Laboratorium kontroli jakości
W obiekcie znajduje się indywidualne laboratorium kontroli jakości, w którym przeprowadzane są badania chemiczne, fizyczne, mikrobiologiczne, badania stabilności oraz testy instrumentalne, takie jak IR, UV, HPLC i GC, dla surowców i produktów gotowych. Cały obszar jest kontrolowany i dobrze utrzymany, z wystarczającą liczbą instrumentów analitycznych do zamierzonych celów badawczych. Wszystkie instrumenty są dobrze oznakowane i odpowiednio skalibrowane.
QA
Dział Zapewnienia Jakości (QA) jest odpowiedzialny za ocenę i kategoryzację odchyleń na poziom Główny, Ogólny i Drobny. Dla wszystkich poziomów odchyleń konieczne jest przeprowadzenie dochodzenia w celu zidentyfikowania przyczyny źródłowej lub potencjalnej. Dochodzenie musi zostać zakończone w ciągu 7 dni roboczych. Po zakończeniu dochodzenia i zidentyfikowaniu przyczyny źródłowej wymagane jest również przeprowadzenie oceny wpływu na produkt wraz z planem CAPA. Odchylenie zostaje zamknięte po wdrożeniu CAPA. Wszystkie odchylenia poziomu muszą zostać zatwierdzone przez Kierownika ds. Zapewnienia Jakości. Po wdrożeniu, skuteczność CAPA jest potwierdzana na podstawie planu.