Tło i projekt badania
Retatrutide (LY3437943) to nowy lek jednopeptydowy, który aktywujetrzy receptory jednocześnie: GIP, GLP-1 i glukagon. Aby ocenić jego skuteczność i bezpieczeństwo u osób z otyłością, ale bez cukrzycy, przeprowadzono randomizowane badanie fazy 2, z podwójnie ślepą próbą i placebo (NCT04881760). Łącznie338 uczestnikówPacjenci z BMI ≥30 lub ≥27 z co najmniej jedną chorobą współistniejącą związaną z wagą zostali losowo przydzieleni do grupy otrzymującej placebo lub retatrutyd (1 mg, 4 mg z dwoma schematami miareczkowania, 8 mg z dwoma schematami miareczkowania lub 12 mg) podawane raz w tygodniu w postaci wstrzyknięcia podskórnego przez 48 tygodni.główny punkt końcowybyła procentową zmianą masy ciała po 24 tygodniach, przy czym drugorzędnymi punktami końcowymi były zmiana masy ciała po 48 tygodniach i progi kategorycznej utraty masy ciała (≥5%, ≥10%, ≥15%).
Kluczowe wyniki
-
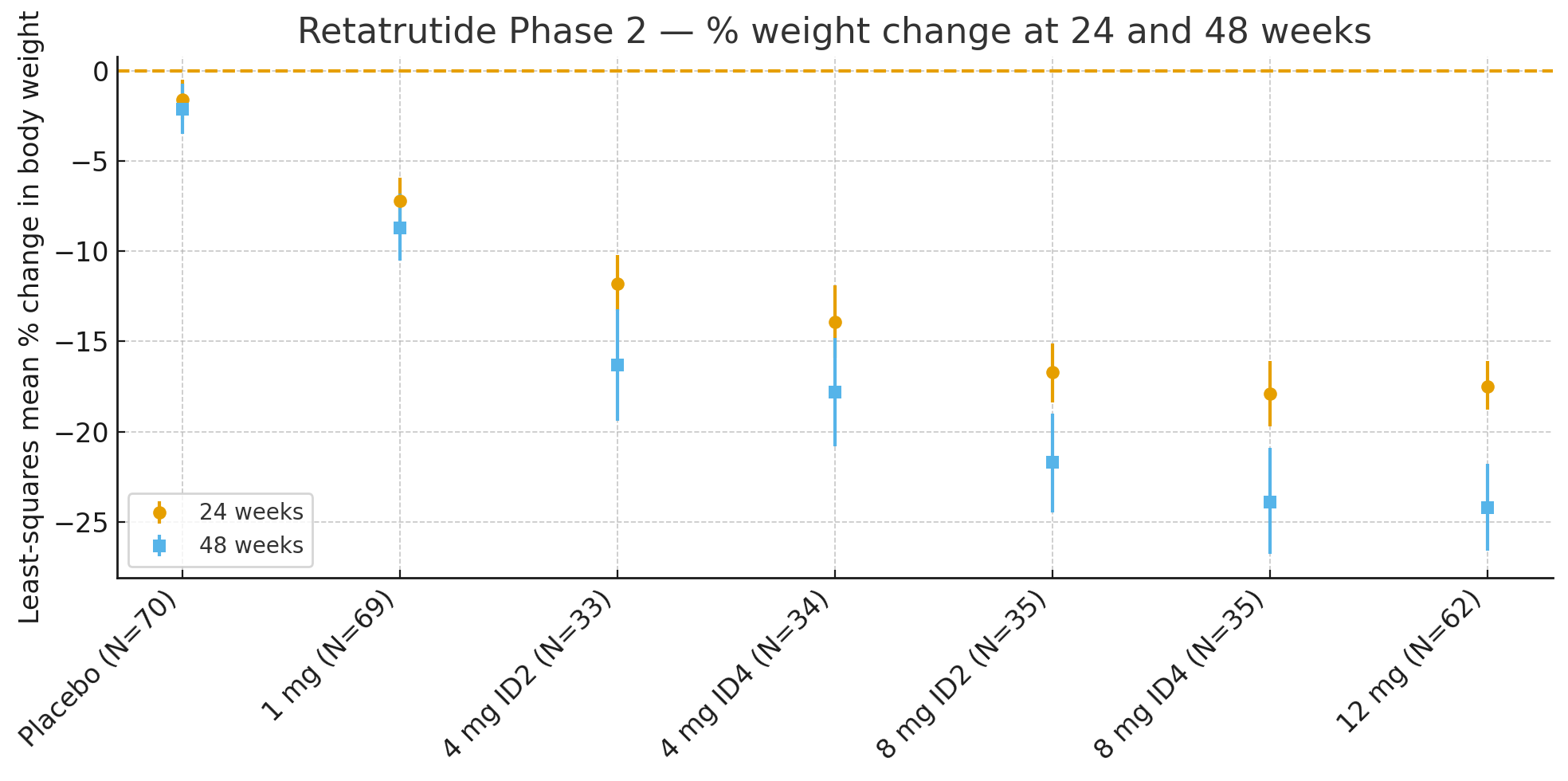
24 tygodnie: Średnia najmniejszych kwadratów zmiany procentowej masy ciała w stosunku do wartości wyjściowej wynosiła
-
Placebo: −1,6%
-
1 mg: −7,2%
-
4 mg (łącznie): −12,9%
-
8 mg (łącznie): −17,3%
-
12 mg: −17,5%
-
-
48 tygodni:Procentowa zmiana masy ciała wynosiła
-
Placebo: −2,1%
-
1 mg: −8,7%
-
4 mg (łącznie): −17,1%
-
8 mg (łącznie): −22,8%
-
12 mg: −24,2%
-
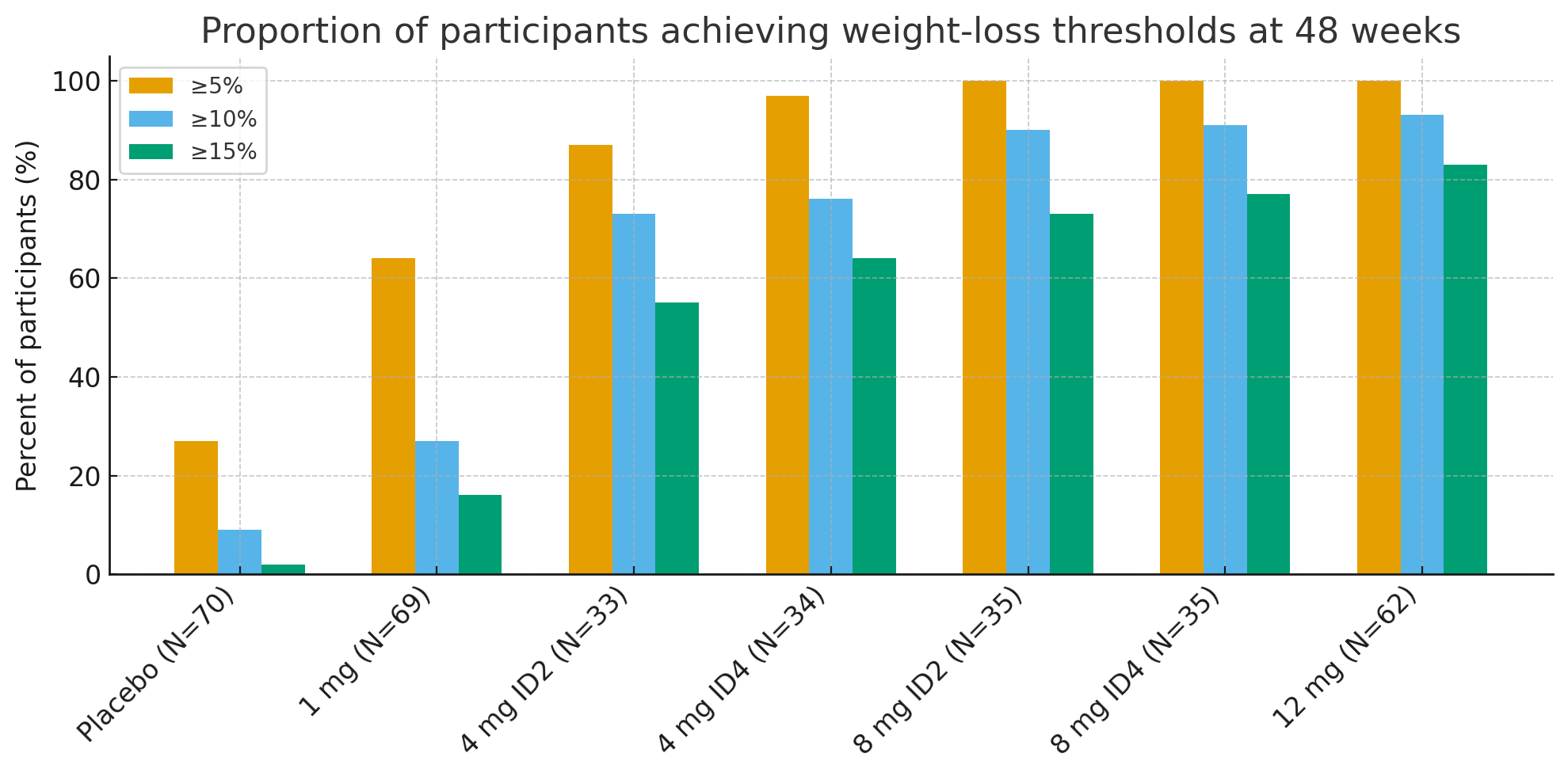
Po 48 tygodniach odsetek uczestników, którzy osiągnęli klinicznie istotne progi utraty wagi, był uderzający:
-
≥5% utraty masy ciała: 27% w grupie placebo w porównaniu do 92–100% w grupie aktywnej
-
≥10%: 9% w grupie placebo w porównaniu z 73–93% w grupach aktywnych
-
≥15%: 2% w grupie placebo w porównaniu do 55–83% w grupach aktywnych
W grupie 12 mg do26% uczestników straciło ≥30% swojej wyjściowej masy ciała, wielkość utraty wagi porównywalna z operacją bariatryczną.
Bezpieczeństwo
Najczęstszymi działaniami niepożądanymi były dolegliwości żołądkowo-jelitowe (nudności, wymioty, biegunka), na ogół o nasileniu łagodnym do umiarkowanego i zależne od dawki. Niższe dawki początkowe (miareczkowanie 2 mg) zmniejszały te zdarzenia. Zaobserwowano zależny od dawki wzrost częstości akcji serca, osiągający szczyt w 24. tygodniu, a następnie malejący. Odsetek osób, które przerwały leczenie, wahał się od 6 do 16% w grupach otrzymujących lek aktywny i był nieco wyższy niż w grupie placebo.
Wnioski
U dorosłych z otyłością bez cukrzycy cotygodniowe podawanie retatrutydy podskórnie przez 48 tygodni spowodowałoznaczne, zależne od dawki zmniejszenie masy ciała(do ~24% średniej utraty masy ciała przy najwyższej dawce), wraz z poprawą markerów kardiometabolicznych. Działania niepożądane ze strony przewodu pokarmowego były częste, ale możliwe do opanowania dzięki miareczkowaniu. Wyniki badań fazy 2 sugerują, że retatrutyd może stanowić nowy punkt odniesienia w terapii otyłości, w oczekiwaniu na potwierdzenie w większych, długoterminowych badaniach fazy 3.
Czas publikacji: 28.09.2025